ტექნოლოგიების სწრაფი განვითარების წყალობით, პროთეზი კიდურები თუ ხელოვნური ორგანოები უკვე სცდებიან იმ ზღვარს, რასაც ბუნება გვთავაზობს. ამჯერად უკვე სისხლის ჯერი დადგა — მკვლევრებმა ჟანგბადის გადამტანი ქსოვილების შექმნის ახალ გზას მიაგნეს.
ბიოლოგიური მასალებისა და ლაბორატორიაში გამოყვანილი პოლიმერების შერევით, ბიოინჟინერთა საერთაშორისო ჯგუფმა შექმნა სისხლის წითელი უჯრედები, რომლებსაც ჩვენს ძარღვებში ბუნებრივად არსებულზე უფრო მეტი შესაძლებლობები აქვთ.
ჰემაგლობინის მატარებელ ამ მიკროსკოპულ კიბორგებს შეუძლიათ გაძვრნენ არა მხოლოდ სისხლძარღვთა სისტემის კუთხეებსა და ნაბზარებში, არამედ შესაძლებელია მათი ისე მოდიფიცირებაც, რომ მიიტანოს სიმსივნის გამანადგურებელი მედიკამენტები, ბიოსენსორები და აღიჭურვოს ციცქნა მაგნიტებით დისტანციურად მართვისთვის.
თუ ადამიანის ორგანიზმის რომელიმე უჯრედის რეკონფიგურაციას შეეცდებით, სისხლის წითელ უჯრედებს, ანუ ერითროციტებს ნამდვილად ვერ გასცდებით. ისინი მიეკუთვნება იმ უიშვიათეს უჯრედებს, რომლებსაც არ აქვთ ბირთვი და ასეთი შედარებითი სიმარტივის გამო, მიმზიდველი სამიზნეა ბიოინჟინერთათვის.
გარდა ამისა, ტრავმებისა თუ სხვადასხვა მიზეზებით სისხლის დაკარგვის გამო, უზარმაზარია მოთხოვნა ვარგისი სისხლის დონაციაზე. შესაბამისად, წარმოუდგენლად მნიშვნელოვანი იქნებოდა მისი შემცვლელის შექმნა.
ამიტომაც, უკვე მიმდინარეობს რამდენიმე კვლევა სინთეთიკური ერითროციტების შექმნაზე. მათი უმეტესობა ეფუძნება საკვანძო მასალების, მაგალითად, ჰემაგლობინის შეგროვებას ადამიანი ან ცხოველი დონორებისგან და მოთავსებას კეთილთვისებიან ნაწილაკებში, რომლებიც ორგანიზმის მხრიდან იმუნურ პასუხს არ აღძრავენ.
ამ მიმართულების ზოგი კვლევა ცოტა უფრო შორსაც წავიდა და ქმნის ხმოვანი სიგნალებით მართულ ნაწილაკებს, რომლებსაც შეუძლია სისხლძარღვათა სისტემის გავლით სიმსივნურ ქსოვილებთან მათ მოსაკლავად მიიტანოს მაღალრეაქტიული ჟანგბადის ტოქსიკური სახეობები.
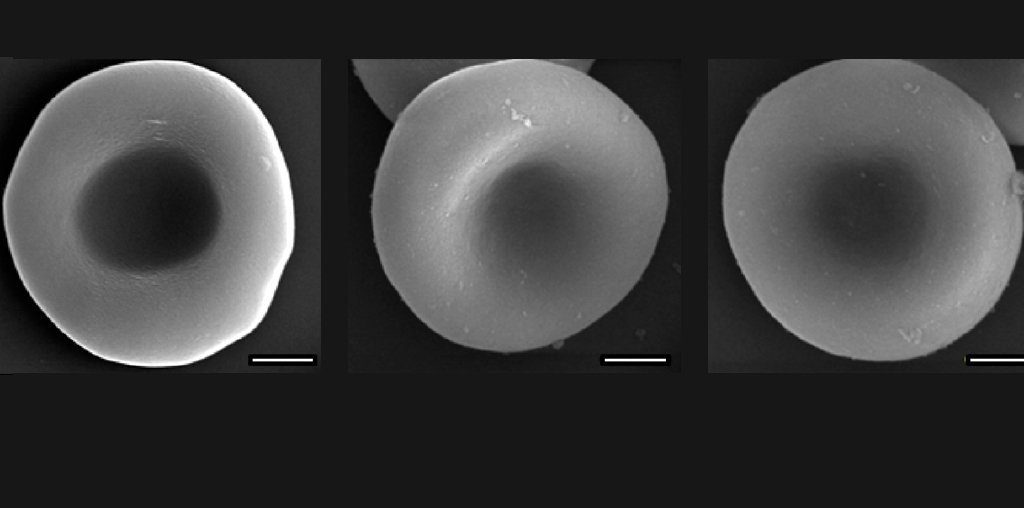
„შთაგონება მოგვცა იმ მოწინავე კვლევებმა, რომელთა ფარგლებშიც შექმნეს ბუნებრივი ერითროციტების რამდენიმე საკვანძო მახასიათებლის მქონე სინთეთიკური ანალოგები; ამჯერად, ჩვენ ვცადეთ შეგვექმნა ერითროციტის გადაკეთებული მოდულური იმიტატორი (RRBC), რომელიც ბუნებრივი ერითროციტების ყველა მახასიათებელს ფლობს“, — წერს ჯგუფი.
ეს კი იმას ნიშნავს, რომ მათ ბიონურ იმიტატორებს აქვთ შესაფერისი ზომა, ფორმა და მოქნილობა, რათა გაიარონ სხეულის ყველაზე ვიწრო სისხლძარღვებში; იმდენ ხანს გაძლონ, რომ გამოსადეგი იყვნენ; და გადაიტანონ შესაბამისი ოდენობის ჟანგბადი.
ამას გარდა, ჯგუფი უფრო შორსაც წავიდა და მათი პატარა ზომის მოდულური ერთეულების შექმნის გზასაც მიაგნო, რაც საშუალებას იძლევა ცვალონ სხვადასხვა მახასიათებლები, რაც უჯრედებს დანიშნულების ადგილამდე მედიკამენტების მიტანაში დაეხმარება.
ამის მისაღწევად, მკვლევრებმა დონორების მიერ გაღებული სისხლის უჯრედები სილიციუმის დიოქსიდის ფენით დაფარეს, შემდეგ კი სხვადასხვა დანიშნულების პოლიმერები გადაუსვეს.
თუ სილიციუმის დიოქსიდსა და უჯრედის შიგნეულობას გამოვაცლით, დარჩენილი პოლიმერული მემბრანის დაფარვა შესაძლებელია სისხლის წითელი უჯრედებისგან დამზადებული კანით.
შედეგად მიიღება ცარიელი ორმხრივ ჩაზნექილი გარსი, რომლის ამოვსებაც შესაძლებელია სხვადასხვა ბიოქიმიური აპარატით ისე, რომ ის ამავე დროს ინარჩუნებს ჟანგბადის გადამტანი ერითროციტის ფუნქციებსაც.
ლაბორატორიულ აღჭურვილობაზე და ცხოველებზე ჩატარებულმა ტესტებმა აჩვენა, რომ სისხლის ბიონიკურმა უჯრედებმა ყოველგვარ მოლოდინს გადააჭარბა. თაგვებში შეყვანიდან ოთხი კვირის შემდეგ, არ აღინიშნებოდა არანაირი გვერდითი ეფექტი და სინთეთიკური უჯრედები აბსოლუტურად უსაფრთხო იყო.
მიუხედავად ამისა, ცხადია, ჯერ დიდი გზაა იქამდე, ვიდრე სისხლის ხელოვნურ უჯრედებზე დაფუძნებულ სამკურნალო მეთოდებს ვიხილავთ. საჭიროა უამრავი ცდა და მასშტაბური წარმოების მთელი პროცესი.
თუმცა, თუ გავითვალისწინებთ, რომ სისხლის უკეთესი უჯრედების შექმნაზე ძალიან ბევრი კვლევაა ფოკუსირებული, ეჭვგარეშეა, რომ ამ მიმართულებით მალე ძალიან ბევრ სიახლეს ვიხილავთ.
როგორც ჩანს, ბიოინჟინრებში საკმაოდ პოპულარულია სტრატეგია, რომელიც მიზნად ისახავს ჩვენი საკუთარი უჯრედების გადაქცევას მკვლელ რობოტებად, რომლებიც თავს ესხმიან უკონტროლო ქსოვილებსა და ინფექციებს. დრო გვიჩვენებს, გაიმარჯვებს თუ არა ეს ფორმულა.
კვლევა ჟურნალ ACS Nano-ში გამოქვეყნდა.
მომზადებულია ScienceAlert-ის მიხედვით.