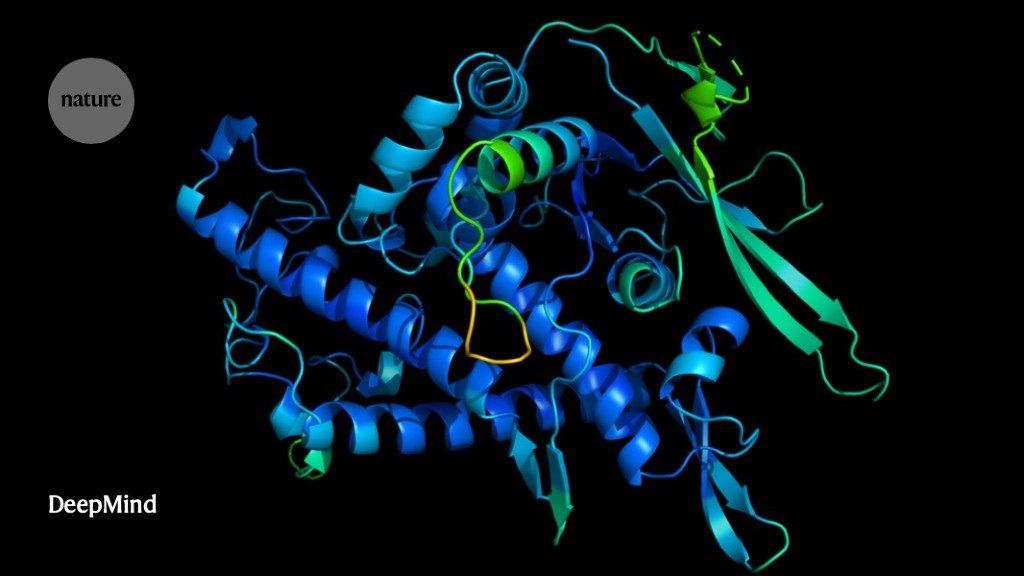
ხელოვნურმა ინტელექტმა ბიოლოგიის ერთ-ერთი უდიდესი გამოწვევა გადაჭრა — იწინასწარმეტყველა, თუ როგორ ეხვევიან ამინომჟავების წრფივი ჯაჭვიდან ცილები 3D ფორმებად, რაც მათ სიცოცხლისათვის საჭირო ამოცანების შესრულების საშუალებას აძლევს. მიღწევა Google-ის ხელოვნური ინტელექტის მიმართულების დანაყოფის, ბრიტანეთში ბაზირებული კომპანია DeepMind-ის მკვლევრებს ეკუთვნის. მათი განცხადებით, DeepMind-ის მიერ აღმოჩენილ მეთოდს შორსმიმავალი ეფექტები ექნება, მათ შორის, დრამატულად დაჩქარდება ახალი მედიკამენტების შექმნა.
„DeepMind-ის ჯგუფის მიღწევა ფანტასტიკურია და შეცვლის სტრუქტურული ბიოლოგიისა და ცილების კვლევის მომავალს“, — ამბობს ევროპის ბიოინფორმატიკის ინსტიტუტის დირექტორ-ემერიტუსი ჯენეტ თორნტონი.
„ეს გახლდათ 50-წლიანი პრობლემა. ვერასოდეს წარმოვიდგენდი, რომ ამას ჩემს სიცოცხლეში მოვესწრებოდი“, — აღნიშნავს მერილენდის უნივერსიტეტის სტრუქტურული ბიოლოგი და სამეცნიერო შეჯიბრ CASP-ის თანადამფუძნებელი ჯონ მოულტი.
ადამიანის სხეული ათობით ათას სხვადასხვა ცილას იყენებს; თითოეული მათგანი მრავალ ამინომჟავების ათასეულ სიმებშია ასხმული. ამ ამინომჟავათა თანმიმდევრობა კარნახობს, როგორ უნდა წარმოქმნას მათ შორის მიმდინარე უთვალავმა ბიძგმა და მიზიდვამ ცილების კომპლექსური 3D ფორმები, რომლებიც თავის მხრივ განსაზღვრავენ მათ ფუნქციონირებას. ამ ფორმების ცოდნა მკვლევრებს ეხმარება ისეთი წამლების შექმნაში, რომლებსაც ცილების ნაპრალებსა და „ჯიბეებში“ მოთავსება შეუძლიათ. სასურველი სტრუქტურის ცილების ხელოვნურად შექმნის შესაძლებლობამ კი უნდა დააჩქაროს ისეთი ფერმენტების შექმნა, რომლითაც დავამზადებთ ბიოსაწვავს და დავშლით პლასმასის ნარჩენებს.
ათწლეულების განმავლობაში, მეცნიერებმა ცილების 3D სტრუქტურა ისეთი ტექნოლოგიების გამოყენებით გაშიფრეს, როგორებიც არის რენტგენული კრისტალოგრაფი და კრიო-ელექტრონული მიკროსკოპი (cryo-EM). თუმცა, ასეთ მეთოდებს თვეები ან წლები სჭირდება და ყოველთვის ეფექტიანი არ არის. ამ დროისათვის სიცოცხლის ფორმებში აღმოჩენილია 200 მილიონზე მეტი ცილა, მაგრამ მათგან დადგენილია მხოლოდ 170 000 ცილის სტრუქტურა.
1960-იან წლებში, მკვლევრები მიხვდნენ, რომ თუ ცილის მიმდევრობებს შორის ინდივიდუალურ ურთიერთქმედებებს გაარკვევდნენ, შეეძლებოდათ მისი 3D ფორმის პროგნოზირებაც. ურთიერთქმედება ერთ ცილაზე ასობით ამინომჟავას და ამინომჟავათა თითოეულ წყვილს მრავალი სხვადასხვა გზით შეუძლია; შესაბამისად, ყოველი მიმდევრობისთვის შესაძლო სტრუქტურათა რიცხვი ასტრონომიულია. ამ პრობლემის გადაჭრას კომპიუტერული მეცნიერები შეეცადნენ, მაგრამ პროგერსი საკმაოდ ნელა მიდიოდა.
1994 წელს მოულტმა და მისმა კოლეგებმა დააფუძნეს შეჯიბრი CASP-ი, რომელიც ყოველ ორ წელიწადში იმართება. მონაწილეები იღებენ ამინომჟავათა მიმდევრობებს დაახლოებით 100 ცილისთვის, რომელთა სტრუქტურაც უცნობია. ზოგიერთი ჯგუფი თითოეული მიმდევრობის სტრუქტურას კომპიუტერულად ითვლის, სხვა ჯგუფები კი მას ექსპერიმენტულად განსაზღვრავენ. ამის შემდეგ, კონკურსის ორგანიზატორები კომპიუტერულ პროგნოზებს ლაბორატორიაში მიღებულ შედეგებს ადარებენ და ამ პროგნოზებს გლობალური მანძილის ტესტის (GDT) ქულას ანიჭებენ. მოულტის თქმით, 90-დან 100-მდე ქულა ექსპერიმენტულ მეთოდებთან გათანაბრებულად მიიჩნევა.
1994 წელსაც კი, პატარა, მარტივი ცილების პროგნოზირებული სტრუქტურა შეიძლება დამთხვეოდა ექსპერიმენტულ შედეგებს. თუმცა უფრო დიდი, რთული ცილებისთვის გამოთვლების GDT ქულა დაახლოებით 20-ს შეადგენდა, რაც „სრული კატასტროფა“ იყო, როგორც ამას CASP-ის ჟიურის წევრი და მაქს პლანკის განვითარების ბიოლოგიის ინსტიტუტის ევოლუციური ბიოლოგი ანდრეი ლუპასი უწოდებს. 2016 წლისთვის, შეჯიბრში მონაწილე ჯგუფებმა ურთულესი ცილებისთვის 40 ქულას მიაღწიეს; ეს მათ ძირითადად CASP-ის სამიზნეთა ახლო ნათესავი ცილების ცნობილი სტრუქტურების საფუძველზე შეძლეს.
ხელოვნური ინტელექტის კომპანია DeepMind-ი შეჯიბრში 2018 წელს ჩაერთო და მისი ალგორითმი, სახელად AlphaFold-ი ეფუძნებოდა ამ შედარებით სტრატეგიას. ალგორითმში ასევე ჩართულია კომპიუტერული მიდგომა, სახელად ღრმა სწავლება (Deep learning), რომელშიც პროგრამულმა უზრუნველყოფამ იცის დიდი ოდენობით მონაცემი და სწავლობს მახასიათებელთა შემჩნევას; ამ შემთხვევაში ეს მონაცემები გახლდათ ჩვენთვის ცნობილი ცილების მიმდევრობები და სტრუქტურები. DeepMind-მა შეჯიბრი მოხერხებულად მოიგო, კონკურენტებს თითოეულ სტრუქტურაზე დაახლოებით 15 პროცენტით სძლია და ურთულესი სამიზნებისთვის დაახლოებით 60 GDT ქულა მიიღო.
DeepMind-ის ალგორითმ AlphaFold-ის ხელმძღვანელის, ჯონ ჯამპერის განცხადებით, ეს პროგნოზები მაინც ძალიან დაუმუშავებელი იყო, რათა გამოსადეგი ყოფილიყო.
„ვიცოდით, რამდენად შორს ვიყავით ბიოლოგიურად რელევანტურობიდან“, — ამბობს იგი.
უკეთესი შედეგების მისაღწევად, ჯამპერმა და მისმა კოლეგებმა ღრმა სწავლება შეურწყეს „ყურადღების ალგორითმს“, რომელიც ბაძავს იმ გზებს, რომლითაც ადამიანმა შეიძლება სურათი-ფაზლი ააწყოს — პირველ რიგში ნაჭრებს პატარა ჯგუფებად აერთებს — ამ შემთხვევაში ამინომჟავათა გროვებად — შემდეგ კი ეძებს გზებს, რომ ეს ჯგუფები ისე შეაერთოს, რათა სრული სურათი მიიღოს. 128 მანქანური სწავლების პროცესორისგან შემდგარ კომპიუტერულ ქსელთან მუშაობით, მათ ალგორითმი 170 000 ცილის ცნობილ სტრუქტურაზე გაწვრთნეს.
და მან იმუშავა. CASP-ის წლევანდელი შეჯიბრის სამიზნე პროტეინებს შორის, AlphaFold-ის მიერ მიღებული საშუალო GDT ქულა 92,4 იყო. ყველაზე რთული ცილების შემთხვევაში, ეს ქულა 87, 25-ს შეადგენდა, რაც ნებისმიერ საუკეთესო პროგნოზს აღემატება. მან ამოხსნა იმ ცილების სტრუქტურებიც კი, რომლებიც უჯრედის მემბრანაშია ჩაჭედილი; ისინი ცენტრალურ როლს ასრულებენ ადამიანის მრავალ დაავადებაში, მაგრამ რენტგენული კრისტალოგრაფიით მათი სტრუქტურის დადგენა ურთულესია. სამედიცინო კვლევების საბჭოს მოლეკულური ბიოლოგიის ლაბორატორიის სტრუქტურული ბიოლოგი ვენკი რამაკრიშნანი ამ შედეგებს „ცილების დაკეცვის პრობლემის გადაჭრაში განსაცვიფრებელ წინსვლას“ უწოდებს.
მოულტის თქმით, წლევანდელ შეჯიბრში ყველა ჯგუფი გაუმჯობესდა. თუმცა, როგორც ლუპასი აღნიშნავს, ალგორთმმა AlphaFold-მა თამაშის წესები შეცვალა. ორგანიზატორები იმასაც კი შიშობდნენ, რომ შეიძლება, DeepMind-ი როგორღაც ცდებოდა. ამიტომ, ლუპასმა სპეციალურ გამოწვევას მიმართა — მიკრობების უძველესი ჯგუფის, არქეების სახეობის მემბრანის ცილას. 10 წლის განმავლობაში, მისმა კვლევითმა ჯგუფმა ყველა ხერხს მიმართა, რათა რენტგენული სხივებით ცილის კრისტალური სტრუქტურა მიეღო, მაგრამ უშედეგოდ.
თუმცა, AlphaFold-მა ეს უპრობლემოდ შეძლო. მან შუაში ორი სპირალური მკლავის მქონე სამნაწილიანი ცილის დეტალური სურათი დადო. მოდელმა ლუპასსა და მის ჯგუფს მათ მიერ მიღებული რენტგენული მონაცემების გაგების საშუალება მისცა; ნახევარ საათში, საკუთარი ექსპერიმენტული შედეგი მათ AlphaFold-ის მიერ პროგნოზირებულ სტრუქტურას დაამთხვიეს.
„თითქმის ბრწყინვალეა. ამას უკვე ვეღარ მოგვატყუებდნენ. არ ვიცი, როგორ შეძლეს მათ ეს“, — ამბობს ლუპასი.
CASP-ში მონაწილეობის მისაღებად, არის პირობა, რომელსაც DeepMind-ი ყველა სხვა ჯგუფის მსგავსად დათანხმდა — მეთოდის შესახებ უნდა წარმოადგინოს საკმარისი დეტალები, რათა მისი გამეორება სხვა ჯგუფებმაც შეძლონ. ამან კი შეიძლება წამლების მწარმოებლებს SARS-CoV-2-ისა და სხვა სახიფათო პათოგენების ყოველი ცილის სტრუქტურის სწრაფად გარკვევის საშუალება მისცეს; მოულტის თქმით, ეს კი საკვანძო ნაბიჯია იმ მოლეკულების საპოვნელად, რომლებიც მათ ბლოკავენ.
თუმცა, AlphaFold-ი კარგად ჯერ ყველაფერს ვერ აკეთებს. შეჯიბრში ის მნიშვნელოვნად წაბორძიკდა ერთ ცილაზე, 52 პატარა, განმეორებადი სეგმენტის ნარევზე, რომელიც შეკრებისას სხვა თითოეულის პოზიციას ამახინჯებს. ჯამპერის განცხადებით, მათ ჯგუფს ახლა სურს, რომ AlphaFold-ს ასეთი სტრუქტურების ამოხსნაც ასწავლონ; ასევე იმ ცილათა კომპლექსებისა, რომლებიც ერთობლივად მოქმედებით უჯრედის ძირითადი ფუნქციების განსახორციელებლად.
მიუხედავად იმისა, რომ ერთი დიდი გამოწვევა დაეცა, აუცილებლად გამოჩნდება სხვები.
„ეს რაღაცის დასასრული კი არ არის, არამედ მრავალი ახალი რამის დასაწყისია“, — ამბობს ევროპის ბიოინფორმატიკის ინსტიტუტის დირექტორ-ემერიტუსი ჯენეტ თორნტონი.
მომზადებულია sciencemag.org-ის მიხედვით.