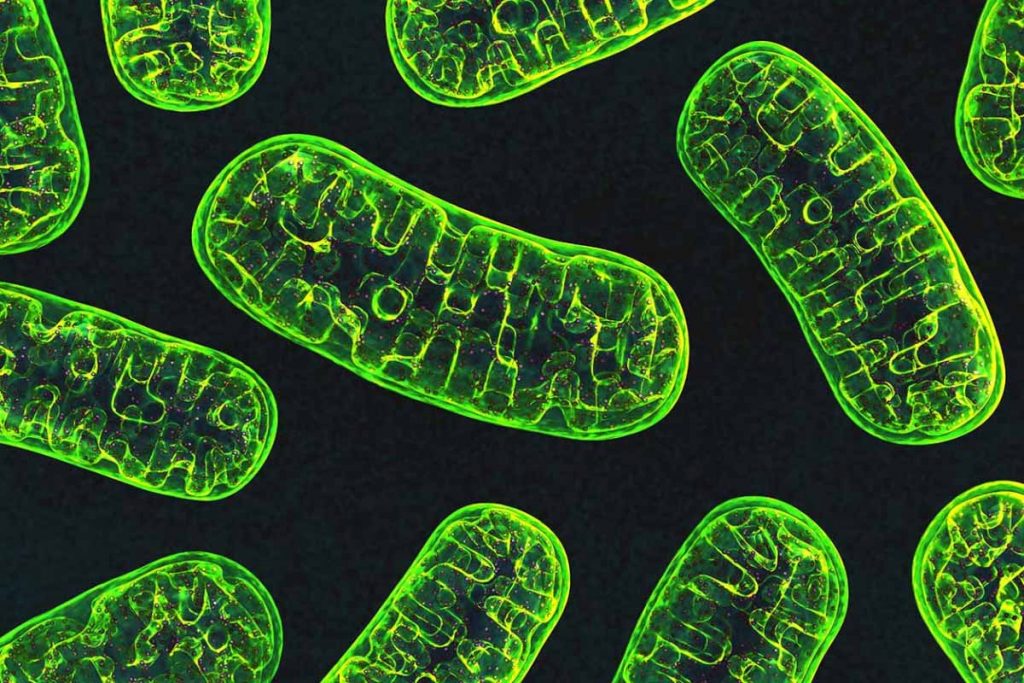
თქვენი ორგანიზმის უჯრედების უმეტესობას ორი გენეტიკური ბიბლიოთეკა აქვს — ერთი ბირთვში, მეორე კი სტრუქტურებში, სახელად მიტოქონდრიებში, რომლებსაც უწოდებენ „უჯრედის ელექტროსადგურებსაც“ უწოდებენ.
ამ დრომდე, ჩვენ მხოლოდ ერთი მათგანის შეცვლის გზა ვიცოდით.
აშშ-ში, მკვლევართა რამდენიმე ჯგუფის ერთობლივმა ძალისხმევამ მიგვიყვანა პროცესამდე, რომელმაც ერთ მშვენიერ დღეს, შეიძლება საშუალება მოგვცეს შევცვალოთ უჯრედის „სხვა“ გენომის ინსტრუქციები და პოტენციურად, შევქმნათ სამკურნალო საშუალება იმ მრავალი დაავადებისთვის, რომელიც ორგანიზმის ენერგიით მომარაგებას უშლის ხელს.
გენების რედაქტირების ამ რევოლუციური ხელსაწყოს მოლეკულური საფუძველია ტოქსინი სახელად DddA, რომელსაც ბაქტერია Burkholderia cenocepacia სხვა მიკრობთა გასანადგურებლად გამოყოფს მაშინ, როდესაც სერიოზულ სახეს იღებს რესურსებისთვის კონკურენცია.
უკვე დიდი ხანია, ამ ტოქსინის ტალანტი ვაშინგტონის უნივერსიტეტის მკვლევართა საგანია. როგორც მათ დაადგინეს, ის ნუკლეინის მჟავის ფუძეს, სახელად ციტოზინს გარდაქმნის სხვა ფუძედ, რომელიც ფართოდ გვხვდება რნმ-ში და ურაცილი ეწოდება.
მეცნიერებმა ამ ბაქტერიული იარაღის დნმ-ზე შეტევას წარსულშიც დაკვირვებიან. უფრო მეტიც, გენეტიკურ ინჟინერიაში აქტიურად იყენებენ ე. წ. დეამინაზ ფერმენტთა მთელ ოჯახს.
სამწუხაროდ, დეამინაზი ფერმენტები კოდის შეცვლის საქმიანობას (დეზამინირება — ამინოჯგუფის მოცილება) მხოლოდ დნმ-ის ერთ ხვეულზე ახდენენ.
ამის გადასაჭრელად, მასაჩუსეტსის ტექნოლოგიური ინსტიტუტისა და ჰარვარდის უნივერსიტეტის ბროუდის ინსტიტუტის მკვლევართა ჯგუფმა კოდის შემცვლელი დეამინაზების კომბინაცია CRISPR-ის ტექნოლოგიაში მოახდინეს, რომელიც რნმ-ის მოდელის გამოყენებით ახდენს მიმდევრობათა იდენტიფიცირებას, შემდეგ კი ფერმენტების გამოყენებით ახდენს ხვეულების გახსნას და ცვლილებების შეტანას.
ეს არც ისე დიდი პრობლემაა, როდესაც დნმ-ის ორი ხვეულის (სპირალი) რედაქტირება გსურთ ისეთ კეთილმოსურნე გარემოში, როგორიც უჯრედის ბირთვია. თუმცა, ასეთი მარტივი არ გახლავთ რნმ-ის მოდელების შეტანა მიტოქონდრიის უფრო სელექციურ მემბრანაში.
ამის მიზეზი კი ის არის, რომ მილიარდზე მეტი წლის წინ, მიტოქონდრია ცალკეული ორგანიზმი იყო; დროთა განმავლობაში ისინი გარდაიქმნენ და პასუხისმგებლობა აიღეს უჯრედებზე, რომლებშიც ისინი ახლა იმყოფებიან და გართული არიან გლუკოზის დაშლით, რითაც უჯრედისთვის საჭირო ენერგიას აწარმოებენ.
მართალია, მას შემდეგ ბევრი მიტოქონდრიული გენი მასპინძლის ბირთვში გადაბარგდა, მაგრამ ენერგიის ეს ციცქნა მწარმოებლები მაინც ფლობენ რამდენიმე მნიშვნელოვან მიმდევრობას, რომლებიც მჭიდროდ არიან ჩაჭედილი მემბრანის საფარს მიღმა, რომელიც მასში რნმ-ის ნაწილების შეღწევას ართულებს.
საბედნიეროდ, DddA-ს აქვს დნმ-ის ორივე სპირალში ცვლილებათა შეტანის უნიკალური ნიჭი, რაც CRISPR ტექნოლოგიას და მის მოუქნელ რნმ მოდელს ნაკლებად გამოსადეგს ხდის ალტერნატიულ მეთოდებთან შედარებით, როდესაც საქმე ეხება სასურველი მიმდევრობის მიზანში ამოღებას და მასში ცვლილების განხორციელებას.
ფაზლის ეს მესამე ნაწილი წარმოდგენილია გენური ინჟინერიის მოძველებულ ხელსაწყოში, რომელსაც TALE-ს უწოდებენ.
შესაძლებელია ფერმენტების ამ კლასის ისე მორგება, რომ მოძებნოს და დაშალოს ნუკლეინის მჟავის სპეციფიკური კოდები. საჭიროა მხოლოდ შესაფერის ადგილას მოვათავსოთ ციტოზინის შესაცვლელი ტოქსინი.
DddA-სთან ერთად, სპეციალურად დამზადებულ TALE ფერმენტს შეუძლია მიტოქონდრიის შიგნით იპოვოს სამიზნე მიმდევრობა და იქ ნაპოვნი ნებისმიერი ციტოზინი ურაცილად გარდაქმნას, რომელიც მოგვიანებით გარდაიქმნება მსგავს დნმ-სპეციფიკურ ფუძედ, რომელსაც თიმინი ჰქვია.
ტესტირების დროს, ეს ცვლილება ცდების დაახლოებით ნახევარში მოხდა.
50/50-ზე ცვლილება შეიძლება არც ისე დიდ გამარჯვებად ჩანდეს, მაგრამ თუ გავითვალისწინებთ, რომ სამიზნე მიმდევრობების გარეთ არ დაფიქსირებულა პოტენციურად გამანადგურებელ ცვლილებათა ნიშნები, ასეთი სიზუსტე იმედისმომცემია გენური ინჟინერიის ხელსაწყოსთვის.
გარდა ამისა, იმის გამო, რომ არ არსებობს მიტოქონდრიული გენების რედაქტირების სხვა ხელსაწყო, მიუხედავად წარმატების დონისა, ეს მიღწევა ნამდვილად საკვანძოა.
ბირთვის დნმ-ში მუტაციებს შეუძლია გამოიწვიოს ჯანმრთელობის სხვადასხვა პრობლემები; ზუსტად ასეთივე პრობლემატური შეიძლება იყოს მიტოქონდრიის გენების მუტაციებიც და გავლენა იქონიოს ყველაფერზე, თავის ტვინის განვითარებიდან დაწყებული, კუნთების ზრდით, ენერგიის დონით, მეტაბოლიზმითა და იმუნიტეტით დამთავრებული.
ძირითადად (თუმცა არა ყოველთვის) მიტოქონდრიის გენები კვერცხუჯრედით, დედის ხაზით გადაეცემა და ნებისმიერი საზიანო მუტაცია შეიძლება თაობებს გადაეცეს. ამ ეტაპზე, ყველაზე უკეთესი, რისი გაკეთებაც შეგვიძლია ის არის, რომ მოვახდინოთ ორი სხვადასხვა დედის უჯრედების კომბინაცია, რათა ამოვიღოთ დაზიანებული მიტოქონდრია.
თუმცა, ახალი DddA ტექნოლოგიით შეიძლება საბოლოოდ შევძლოთ ცხოველური მოდელების შექმნა, რომლებიც ადამიანებში ჩაანაცვლებენ დაზიანებულ მიტოქონდრიის ფუნქციებს. და კიდევ, ერთ მშვენიერ დღეს იქნებ მათი „შეკეთება“ უშუალოდ ჩვენსავე ორგანიზმშიც შევძლოთ.
კვლევა ჟურნალ Nature-ში გამოქვეყნდა.
მომზადებულია ScienceAlert-ის მიხედვით.